| This page in English! |
 Kegelschnecke (Conus geographus ?). Bild: Jeffrey Jeffords, (Dive Gallery). |
![]() Kegelschnecken (Conidae).
Kegelschnecken (Conidae).
Es gibt etwa 500 Arten von Kegelschnecken, die sich ausschließlich räuberisch ernähren. Die meisten davon ernähren meereslebende Würmer und andere Weichtiere, einschließlich ihrer Artgenossen. Man bezeichnet diese Kegelschnecken als molluscivor. Etwa 70 größere Kegelschneckenarten hingegen sind piscivor - sie ernähren sich von kleinen Fischen.
Diese Kegelschnecken sind meist deutlich langsamer als ihre Beute. Es gelingt ihnen nur, diese zu erlegen, weil sich im Verlauf ihrer Evolution eine einzigartige Beutefangmethode entwickelt hat, die es ihnen ermöglicht, ihre Beute ungeachtet deren größerer Geschwindigkeit zu erlegen - Gift. Kegelschnecken besitzen einen Giftapparat, dessen Nervengift so wirksam ist, dass es die Beute, abhängig von ihrer Größe, innerhalb von Sekunden lähmt und tötet.
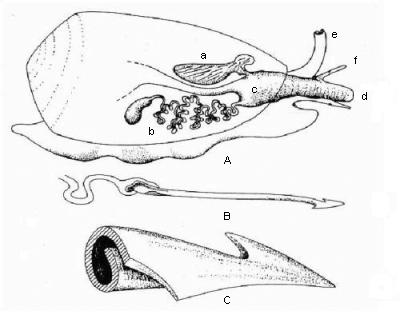 Giftapparat einer Kegelschnecke. A: Anatomischer Bau des Giftapparates und beteiligter Organe. B: Giftpfeil bei der Anwendung. C: Stark vergrößerte Darstellung eines einzelnen Giftpfeils. a: Pfeilsack; b: Giftdrüse (Oesophagealdrüse); c: Pharynx; d: Proboscis; e: Sipho; f: Augenträger (Fühler). Quelle: S. Frings und D. Grammig: Conotoxine - Muskelgifte der Kegelschnecken. |
Das Gift der Kegelschnecken wird mit Hilfe der Zähne der Raspelzunge (Radula) übertragen, die sich im Verlauf der Evolution stark verändert haben. Im Gegensatz zu anderen Schnecken, die eine Vielzahl von Radula-Zähnen besitzen, besitzen Kegelschnecken nur noch eine geringe Anzahl von Zähnen. Sie bestehen aus einem Chitinblättchen, das zu einer hohlen Harpune umgebildet ist, deren Spitze einen Widerhaken aufweist. Nur immer ein Radulazahn sitzt an der Spitze der Radula und wird an seinem Ende aus einer Giftdrüse mit Gift versorgt. Die Ersatzzähne der Kegelschnecke befinden sich in einem sackartigen Organ am inneren Ende der Radula. Von hier werden sie nachgelegt, nachdem eine Harpune verbraucht worden ist.
Die Giftdrüse der Kegelschnecke ist lang und schlauchförmig. Im Verlauf der Entwicklung des Giftapparates ist sie aus einer Speicheldrüse der Schnecke entstanden. (Hinweis: Auch das Gift der Kraken wird von einer umgebildeten Speicheldrüse produziert, siehe z.B. Blauringkraken).
Kegelschneckengifte bestehen aus Oligopeptiden, kurzkettigen Eiweißmolekülen. Damit es der Schnecke nicht selbst gefährlich wird, entsteht das Gift einer Kegelschnecke zunächst in mehreren ungefährlichen Bausteinen, die in Emulsion gespeichert werden. Erst kurz vor der Anwendung verbinden sich die einzelnen Bausteine zum eigentlichen Nervengift, dem Conotoxin.
Durch den Rüssel (Proboscis) der Kegelschnecke,ihre verlängerte Schnauze, wird die Harpune gerichtet und der Beute in der Körper gestochen. Durch die hohle Harpune wird das Gift anschließen in den Organismus injiziert.
 Conus marmoreus frisst eine Kaurischnecke (Cypraea caput- serpentis). Bild: James McVey.  Radula-Zahn einer Kegelschnecke. Quelle: Unterwasserbilder von D. und W. Fritz. |
Conus purpurascens z.B., eine Fisch fressende Kegelschnecke, lauert versteckt im Ozeanboden und bietet seine Atemröhre, den Sipho, als Köder an. Zusätzliche Geruchssinneszellen (Chemorezeptoren) dienen der Schnecke als zusätzliche Orientierung über die Vorgänge in der Außenwelt. Wenn der Fisch die Beute annimmt, streckt die Schnecke den Rüssel aus und schießt dem Fisch den Giftpfeil "direkt ins Gesicht".
Das Gift bewirkt zunächst eine Verkrampfung der Bewegungsmuskulatur und später eine totale Lähmung des Fisches, der nun gefahrlos von der Schnecke verschlungen werden kann.
Wie oben bereits erwähnt, sind die Gifte der Kegelschnecke Oligopeptide, d.h. kurzkettige Eiweißmoleküle, die aus etwa 30 Aminosäurebausteinen bestehen. Abhängig von dieser Primärstruktur bilden sich Disulfidbrücken zwischen Aminosäureresten, die Schwefel enthalten, wie etwa Cystein (cys). Diese Disulfidbrücken entscheiden im Endeffekt über die räumliche Struktur des Giftes und dadurch über seine mögliche Wirkung: Die Wirkung von Eiweißmolekülen hängt entscheidend von ihrer räumlichen Struktur ab, die sich aber in Folge von äußeren Faktoren, wie Temperatur, pH u. a., verändern kann.
Conotoxine bestehen nun aber nicht aus einem einzigen Typ von Molekül, sondern aus mehreren Bausteinen. Aus diesem Grund bewirkt das Gift von Conus purpurascens (s.o.) zunächst eine Verkrampfung und später eine Lähmung der Beute.
Wegen ihrer unterschiedlichen Wirkungen unterscheidet man α-, μ-, ω-, κ- und δ-Conotoxine.
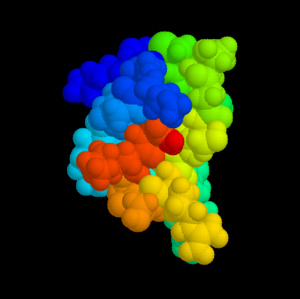 Omega-Conotoxin MVIIA (Ziconotid). Die verschiedenen Bau- steine des Peptids sind farblich unterschieden. Quelle: Cone Shells and Conotoxins. |
Um die Wirkung eines Nervengifts wie des Conotoxins verstehen zu können, muss man sich vergegenwärtigen, dass Informationen in den Nervenzellen in Form so genannter Aktionspotentiale (APs) weitergegeben werden. Aktionspotentiale entstehen durch eine Depolarisation der Nervenzellmembran, indem gesteuerte Ionenkanäle die Ionenkonzentration innerhalb und außerhalb der Membran verändern. Die wichtigsten Ionenkanäle sind dabei die Natrium-Kanäle, die den Fluss von Na+-Ionen von außen nach innen steuern, sowie die Kalium-Kanäle, die den Fluss von K+-Ionen von innen nach außen regulieren. Während die δ-Conotoxine an Natrium-Kanälen binden, binden κ-Conotoxine an den Kalium-Kanälen und setzen sie so jeweils außer Funktion. Da nun die beiden wichtigsten Ionen-Kanäle nicht arbeiten, findet eine Weiterleitung des Aktionspotentials nicht statt, die Nervenleitung ist unterbrochen. Je nach Wirkung der Nervenzelle (erregend oder hemmend) führt dies zu einer Verkrampfung oder Lähmung des Muskels, den die Nervenzelle steuert.
|
Die tödlichsten Tiere der Welt - Australien. Die Landkarten-Kegelschnecke, Conus geographus. Quelle: YouTube. |
Synapsen stellen die Verbindung zwischen Nervenzellen und anderen Nervenzellen (interneurale Synapsen), sowie zwischen Nervenzellen und Muskeln (motorische Endplatte), dar. Hier wird der elektrische Reiz des Aktionspotentials in einen chemischen Reiz umgewandelt, der von einer zur anderen Nervenzelle oder an einen Muskel übertragen werden kann. Dazu verursacht das ankommende Aktionspotential einen Einstrom von Ca2+-Ionen, der zur Produktion von Acetylcholin, einem Neurotransmitter, führt. Das Acetylcholin überquert die postsynaptische Spalte und bindet an Rezeptoren auf der Membran der folgenden Nervenzelle. Dies hat nun wieder den Einstrom von Na+-Ionen zur Folge, der zur Bildung eines neuen Aktionspotentials führt (s.o.). Während die ω-Conotoxine den Einstrom von Ca2+-Ionen verhindern, indem sie dien entsprechenden Kanäle abschalten, verhindern die α-Conotoxine eine Bindung von Acetylcholin an die postsynaptischen Rezeptoren und so die Entstehung eines neuen Aktionspotentials.
Aufgrund ihres Aufbaus sind Conotoxine hochspezifisch wirksam. Gelingt es der Biochemie, einzelne Bausteine von Conotoxinen nach ihrer Wirkung zu isiolieren, so können gezielt bestimmte Nervenwirkungen beeinflusst und so z.B. Schmerzsymptome behandelt werden. Sowohl am Allgemeinen Krankenhaus (AKH) in Wien, als auch an Kliniken in den USA wird an der möglichen Verwendung von Conotoxinen als Schmerzmittel geforscht. Der Vorteil der Conotoxine als Schmerzmittel liegt in ihrer Spezifizität und der Tatsache, dass sie den Körper garantiert nicht süchtig machen, ganz im Gegenteil zu Schmerzmitteln auf Morphinbasis. Aus diesem Grund können Conotoxin-Derivate besonders bei chronischen Schmerzen gut eingesetzt werden.
Weiterführende Informationen:
Literatur:
_____________________________
*) Literaturstelle freundlicherweise zur Verfügung gestellt von Peter Garn.